Dinâmica epidemiológica do Vírus da Bronquite Infecciosa Aviária na América do Sul
O Vírus da Bronquite Infecciosa Aviária (IBV) permanece como um dos desafios sanitários mais complexos para a avicultura industrial, impondo perdas econômicas severas devido à sua alta contagiosidade e plasticidade genética. Como um Gammacoronavirus propenso a recombinações e mutações frequentes, o IBV não se apresenta como um inimigo estático, mas como uma população viral em constante fluxo [1]. A classificação baseada no gene da glicoproteína Spike (S1) funciona hoje como o mapa essencial para navegar por essa diversidade, revelando um cenário onde diferentes linhagens competem por nichos biológicos e desafiam a imunidade dos plantéis [1,4].
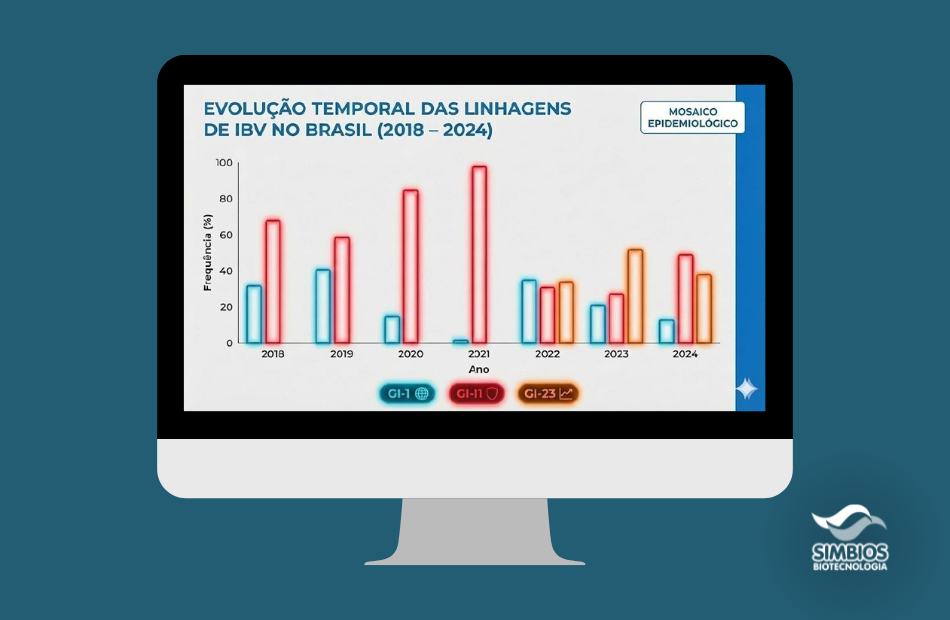
A análise histórica dos dados epidemiológicos desenha, inicialmente, um quadro de coexistência competitiva entre linhagens estabelecidas. A onipresença da linhagem GI-1 atua como um "ruído de fundo" constante, refletindo o uso massivo de cepas vacinais Massachusetts em nível global, que circulam tanto como vírus vacinais quanto em formas recombinantes de campo [1,5]. Paralelamente, a linhagem GI-11 demonstra uma resiliência notável; consolidada na América do Sul há mais de duas décadas, ela representa a adaptação biológica ao ambiente local, mantendo-se predominante até recentemente em virtude de seu ajuste evolutivo aos hospedeiros da região [1,5].
Entretanto, este equilíbrio foi rompido pela permeabilidade das fronteiras sanitárias, evidenciada inicialmente pela detecção esporádica de variantes alóctones como a GI-13 (europeia) e a GI-16 (asiática). Embora sua frequência seja menor, a presença destas linhagens atua como sentinela da globalização viral, comprovando que a América do Sul é um ponto de convergência para patógenos de múltiplas origens geográficas [1].
A mudança mais drástica e recente no gráfico epidemiológico, contudo, é ilustrada pelo fenômeno de "turnover" viral protagonizado pela linhagem GI-23 (ou Variante 2 - Var2). Estudos filogenéticos e filodinâmicos conduzidos pela Simbios Biotecnologia elucidam que, após um provável período de circulação silenciosa iniciada por volta de 2018, esta variante encontrou um vácuo imunológico nos plantéis vacinados, resultando em um crescimento exponencial a partir de 2022 [2,3]. O comportamento explosivo da GI-23 nos dados de campo não reflete apenas uma nova introdução, mas uma substituição de nicho, onde uma variante exótica e de alta patogenicidade supera as barreiras locais e passa a dominar o cenário [2].
Essa transição de uma epidemiologia estática para uma dinâmica multipolar e agressiva torna obsoletos os diagnósticos genéricos. Para responder a essa complexidade com a precisão exigida, a Simbios Biotecnologia estruturou uma plataforma integrada de soluções diagnósticas.
Na vertente de Serviços de Análise, o laboratório atua como centro de referência, processando amostras complexas através de ensaios de PCR em Tempo Real (qPCR) para triagem de alta sensibilidade e, crucialmente, através do Sequenciamento de DNA do gene S1. Esta abordagem permite não apenas a detecção do vírus, mas a tipificação exata da linhagem circulante e a análise filogenética, indispensáveis para a atualização das estratégias vacinais.
Complementarmente, compreendendo que a velocidade de resposta é vital para o controle de surtos, a empresa expandiu suas fronteiras com a Linha New Gene. Esta tecnologia confere autonomia ao sanitarista, possibilitando a realização de diagnósticos moleculares de alta fidedignidade in loco – diretamente no laboratório da Agroindústria. Com reagentes de Amplificação Específica desenhados para a realidade local (incluindo kits dedicados para IBV genérico e discriminação de linhagens críticas), a Simbios permite que a precisão do laboratório molecular seja levada ao campo, garantindo agilidade na tomada de decisão frente a um vírus que não para de evoluir.
Referências bibliográficas
[1] LUNGE, V. R.; KIPPER, D.; STRECK, A. F.; FONSECA, A. S. K.; IKUTA, N. Emergence and Dissemination of the Avian Infectious Bronchitis Virus Lineages in Poultry Farms in South America. Veterinary Sciences, v. 12, n. 5, p. 435, 2025.
[2] IKUTA, N.; KIPPER, D.; FREITAS, D. S. S.; FONSECA, A. S. K.; LUNGE, V. R. Evolution and Epidemic Spread of the Avian Infectious Bronchitis Virus (IBV) GI-23 in Brazil. Viruses, v. 15, n. 6, p. 1229, 2023.
[3] IKUTA, N.; FONSECA, A. S. K.; FERNANDO, F. S.; FILHO, T. F.; MARTINS, N. R. S.; LUNGE, V. R. Emergence and molecular characterization of the avian infectious bronchitis virus GI-23 in commercial broiler farms from South America. Transboundary and Emerging Diseases, v. 69, n. 6, p. 3167-3172, 2022.
[4] FRAGA, A. P.; BALESTRIN, E.; IKUTA, N.; FONSECA, A. S. K.; SPILKI, F. R.; CANAL, C. W.; LUNGE, V. R. Emergence of a New Genotype of Avian Infectious Bronchitis Virus in Brazil. Avian Diseases, v. 57, n. 2, p. 225-232, 2013.
[5] BALESTRIN, E.; FRAGA, A. P.; IKUTA, N.; CANAL, C. W.; FONSECA, A. S. K.; LUNGE, V. R. Infectious bronchitis virus in different avian physiological systems: A field study in Brazilian poultry flocks. Poultry Science, v. 93, n. 8, p. 1922-1929, 2014.